Nachfolgend dargestellt ist ein Auszug aus dem Zwischenbericht der Tokeya Deep Data Dive GmbH & Co. KG an den Projektträger des BMBF, der VDI VDE IT GmbH in Berlin. Die angegebenen Arbeitspakete sind im Projektplan enthalten, wie in GVB und TVB dargestellt. GVB (Gesamtvorhabenbeschreibung) und TVB (Teilvorhabenbeschreibung) sind in Auszügen als PDF unter „Downloads“ verfügbar.
Arbeitspaket 1.1 - Aggregierung verschiedener neuropsychologischer Tests zu einer ToCA-Test-Batterie
Das AP 1.1 wurde wie geplant umgesetzt, verschiedene neuropsychologische Tests wurden zu einer ToCA (Tokeya Cognitive Assessment)-Test-Batterie kombiniert, mithilfe derer die Probanden in die jeweiligen Patientengruppen eingeteilt werden können (Alzheimer-Patienten, Patienten mit leichter kognitiver Beeinträchtigung, Gesunde).
Die ToCA-Test-Batterie umfasst bislang:
- ToCA-Test (Erweiterung des Montreal Cognitive Assessment = MoCA-Test, https://www.mocatest.org/)
- Stroop-Test (Vertauschung von Farb- und Wortbedeutung, siehe Abb. 3)
- Bilder erinnern (Erinnerung an bestimmte Einzelbilder in einer Sequenz von Bildern)
- Handschrift (Schreiben von Buchstaben und Auswertung von typischen Merkmalen)
- Labyrinth (Herausfinden aus Labyrinth bzw. Finden in eines hinein)
- Spirale (Führen eines Linienzugs innerhalb einer Spirale, ohne anzuecken) – relevant für Parkinson
Zudem wurden Komponenten des Grundkonzept des MFC (Mental Fitness Coach) entworfen, die im QI des Jahres 2020 implementiert werden.
Zur ToCA-Test-Batterie werden nachfolgend 4 Bilder zu ausgewählten Aufgaben gezeigt:
- Abb. 1: Uhr zeichnen, die Auswertung erfolgt automatisch, Ziffern, kleiner/ großer Zeiger korrekt
- Abb. 2: Würfel zeichnen – Es wird automatisch die geometrische Form ermittelt, rot=falsch
- Abb. 3: Stroop-Test – Neben der verbalen und visuellen Konsistenz wird auch Zeit gemessen
- Abb. 4: Labyrinth – Ein korrektes Durchlaufen des Labyrinths ist ohne „rot“ angezeigte Fehler
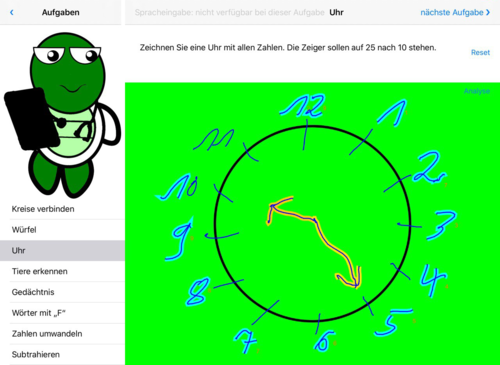
Abb. 1: Uhr – die Uhr wurde korrekt erkannt. Die Anzeige ist in grüner Farbe.
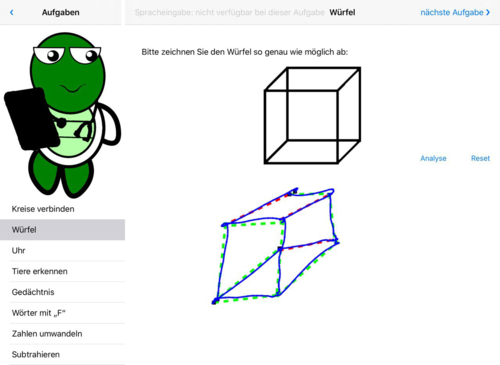
Abb. 2: Würfel, teilweise korrekt – der Würfel wurde von der Perspektive zwar getroffen, die Eckpunkte und die Kanten jedoch teilweise nicht
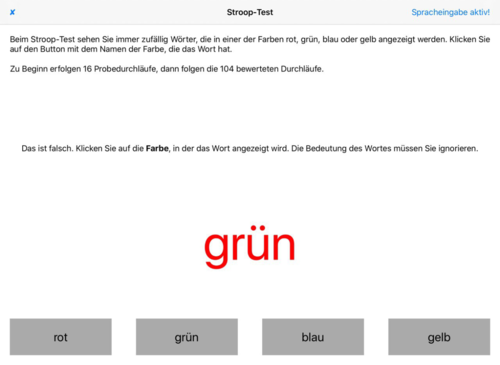
Abb. 3: Stroop-Test mit erkanntem Fehler - die gesehene Farbe wird kognitiv von der Wortbedeutung getrennt.
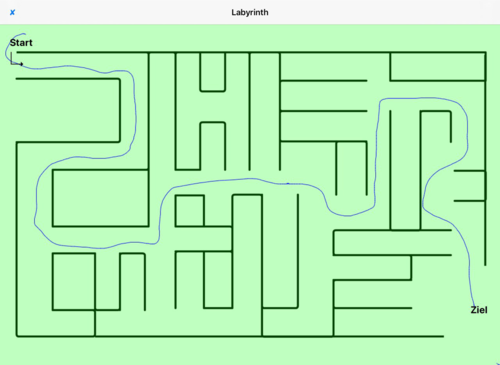
Abb. 4: Labyrinth – die Route zum Ziel wurde korrekt bestimmt, Anzeige in grüner Farbe.
Arbeitspaket 1.2 - Implementierung des HCI (Human Computer Interface), der Abfrage des persönlichen Kontextes sowie des Riechtests
Zunächst mussten in diesem AP die Fragebögen für den Ethikantrag fertiggestellt werden, aufgrund derer die persönlichen Daten erhoben werden können. Hinsichtlich des Riechtestes bedurfte es intensiver Recherchen bzgl. des aktuellen Wissensstandes. Nach Devanand et al. (2019) zeigte sich anhand einer großen Longitudinalstudie, dass bei erfolgreicher Absolvierung des B-SIT-Riechtests der University of Pennsylvania die Wahrscheinlichkeit, innerhalb der nächsten 4 Jahre an Alzheimer zu erkranken, 3.4 % beträgt. (Brief Smell Identification Test from University of Pennsylvania, siehe UPSIT https://en.wikipedia.org/wiki/University_of_Pennsylvania_Smell_Identification_Test)
Der entsprechende Riechtest (B-SIT, wie im Artikel beschrieben) der Firma Sensonics Inc. (www.sensonics.com), der vorerst händisch durchgeführt wird, soll in den ersten Studiensitzungen getestet werden. Alternativ kann auch ein Test der Firma Burghart Messtechnik GmbH aus Deutschland (www.burghart-mt.de) verwendet werden. Derzeit ist noch nicht absehbar, ob wegen der COVID-19-bedingten Krisen-Situation der Test in der erforderlichen Weise umgesetzt werden kann.
Hinweis: Aktuell wurde mit der Entwicklung einer App begonnen, welche die wesentlichen Tests (siehe oben), Interviews und Befragungen aufgrund der COVID-19-Krise remote per Tele-Session ermöglichen soll. Dies schließt auch den Riechtest ein, wenn dieser vor Ort von autorisiertem Personal mit den Patienten durchgeführt wird.
Arbeitspaket 2.2 - Veranlassung und Durchführung des Prüfverfahrens durch die Ethikkommission
An den Arbeiten dieses Arbeitspaketes beteiligte sich Tokeya zur Unterstützung der FAU bei den umfassenden Arbeiten zum Ethikantrag. Dieser wird, bedingt durch die COVID-19-Krisen-Situation, in mehrere Teile gesplittet, so dass zum jetzigen Zeitpunkt nach Genehmigung bereits Interviews für die Vorstudie stattfinden können. Die Einreichung an die Ethikkommission der Friedrich-Alexander-Universität Erlangen-Nürnberg erfolgt über das Jahr 2020 hinweg. Außerdem wurde parallel zum Ethikantrag ein Datenschutzkonzept entworfen, das bereits dem Ethikantrag Teil I (Einreichung Mai 2020) beigefügt wird.
Arbeitspaket 2.3 - Erstellung von Dokumenten zur Probandenaufklärung
Die Dokumente zur Probanden-Aufklärung wurden erstellt und dem Ethikantrag Teil I beigefügt. Die Dokumente umfassen für die Vorstudie:
- Teilnahmeinformation
- Einverständniserklärung
- Datenschutzrechtliche Einwilligungserklärung mit Hinweisen zum Datenschutz
Arbeitspaket 3.1 - Explorative Auswahl des am besten geeigneten KI-Modellansatzes
Es hat sich im Zuge der bisherigen Arbeiten herauskristallisiert, dass eine enge Verzahnung von KI-basierten Prädiktionsverfahren für die multivariaten EEG-Zeitreihen von verschiedenen Gruppen (Alzheimer-Patienten (AD) unterschiedlichen Schweregrads, MCI (Mild Cognitive Impairment = leichte kognitive Beeinträchtigung) und HC (Healthy Controls = Gesunde)) mit der Bestimmung der unter Punkt 4.3. genannten nichtlinearen Größen Entropie und Fraktale Dimension erforderlich ist. Anhand der vorhandenen Test-Daten konnten die beiden genannten Größen näher untersucht werden. Aufgrund der Resultate in der Literatur konnten hiermit bereits Verbesserungen implementiert werden, in Form der Multi-ScaleEntropy (MSE), welche sich in einer Vielzahl von Anwendungen als außerordentlich ergiebig erwies, siehe Costa (2002, 2005).
Ziel für dieses Arbeitspaket ist die Entwicklung einer multimodalen Prozedur, welche es aufgrund der Analyse verschiedener signifikanter Parameter der EEG-Zeitreihen in Verbindung mit den nichtlinearen Größen HFD (Higuchi Fractal Dimension, bereits in der TVB und GVB hinreichend charakterisiert, siehe Downloads) und MSE erreicht, Individuen so gut wie möglich von den zugehörigen Gruppen zu unterscheiden. Dies ist uns in einem ersten Schritt gelungen, siehe die nachfolgenden Abbildungen 5-8. Die offensichtlichen Unterschiede der MSE- und HFD-Werte von AD-Einzelprobanden gegenüber denjenigen der Gruppen müssen im Berichtsjahr 2020 in einer formalen KI-Prozedur (z. B. einem adaptiven, mehrdimensionalen Entscheidungsbaum) zusammengeführt, ggf. erweitert um zusätzliche, die Diskriminierung vertiefende Parameter, und z. B. diejenigen Skalen jeweils in der aktuellen Situation adaptiv ermittelt werden, welche für die Differenzierung besonders signifikant sind, siehe hierzu auch Park (2007).
Unabdingbar hierfür ist eine deutlich größere Zahl von z.T. selbst ermittelten EEG-Daten von AD-Patienten neben dem vorhandenen geringen Datenbestand. Da dies aus Gründen der aktuellen Beschränkungen in den Pflegeheimen aufgrund von COVID-19 derzeit nicht möglich ist, müssen wir – improvisierend bis zur Ermöglichung der eigenen EEG-Untersuchungen ggf. erst im Jahr 2021 – auf die Datenbestände von anderen Forschungsgruppen in Europa zurückgreifen, um die neuen Algorithmen wenigstens in ersten Schritten gemäß der Planung in der TVB entwickeln zu können. Es seien hier nur die Verantwortlichen der Forschergruppen genannt: Bruno Dubois in Frankreich, Claudio und Fabio Babiloni in Italien, Erol Başar und Bahar Güntekin in der Türkei, Nesma Houmani und François Vialatte, ebenfallsin Frankreich, Javier Escudero und Daniel Abasolo in Großbritannien, vormals Spanien. Die Beschaffung dieser Daten im wechselseitigen Einvernehmen und Nutzen wird in der aktuellen COVID-19-Krisen-Situation weitere erhebliche Aufwendungen bedeuten.
Erläuterung der Ergebnisse zur Diskriminierung der MSE von Einzel-Individuen von den Gruppen:
Bei einer Vielzahl neurologischer Erkrankungen wie z. B. der Alzheimer- oder Parkinson-Krankheit lassen sich quantitative und qualitative Veränderungen im EEG-Signal nachweisen. Hierbei wird oft eine Zu- oder Abnahme der Komplexität des EEG-Signals beobachtet. Diese Veränderung der Komplexität kann durch verschiedene Entropiemaße quantifiziert werden, siehe u.a. Park (2007).
Um dies anhand der Entropie als Maß der (Nicht-)Vorhersagbarkeit des EEG-Signals zu demonstrieren, wurde ein Datensatz aus dem Jahre 2006 bestehend aus den EEG-Messungen von 12 Alzheimer-Patienten (AD) und 11 gesunden Patienten (HC) aus Valladolid (Spanien) ausgewertet (Herkunft der Daten, siehe Smith 2017).
Zunächst wurden im Berichtszeitraum die Mittelwerte der MSE für alle Messungen (siehe hierzu Escudero (2006)) sowohl für die AD-Gruppe und die HC-Gruppe jeweils für 16 Elektroden bestimmt. Die MSE misst auf unterschiedlichen Zeitskalen die Wahrscheinlichkeit dafür, dass Mengen von Mustern, die für eine Anzahl von Datenpunkten ähnlich sind, auch einen Datenpunkt weiter noch ähnlich sind. Mehr (d.h. eine höhere) Komplexität in den Mustern drückt sich hier in höheren Werten der MSE aus.
Es ergaben sich für die HC-Gruppe, mit Ausnahme der höchsten Zeitskalen, höhere Werte der MSE als bei der AD-Gruppe, was zur Unterscheidung von Alzheimer-Patienten und Gesunden verwendet werden kann.
Da die MSE für sehr kurze Signale nur unzuverlässige Werte liefern kann und sie zudem einen hohen Rechenaufwand erfordert, soll die Komplexität im QI/2020 auch mit anderen Entropiemaßen bestimmt werden. Hierauf wird im Berichtszeitraum 2020 näher eingegangen.
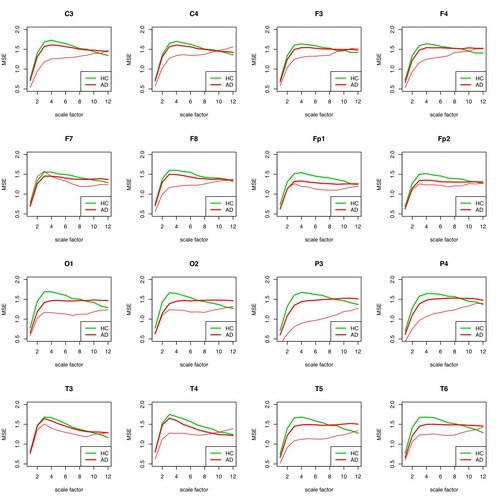
Abb. 5: MSE für jede einzelne Elektrode für Patient 1 (AD) gegenüber der Gruppe der restlichen AD-Patienten und der Gesunden aufgetragen. Die Patienten-Einzel-Kurve ist in dünnem Rot, die Gruppen-Kurve in fettem Rot aufgetragen. In der AD-Gruppe befinden sich alle anderen AD-Patienten außer #1.
- Escudero J., Abasolo D., Hornero R., Espino P. and López M. (2006). Physiological Measurement, Vol. 27, No. 11. IOP Publishing Ltd. Bristol (UK). https://iopscience.iop.org/article/10.1088/0967-3334/27/11/004
- Smith, K. (2017). Accounting for the Complex Hierarchical Topology of EEG Functional Connectivity in Network Binarisation. University of Edinburgh, referenziert durch https://arxiv.org/abs/1610.06360. Daten in https://datashare.is.ed.ac.uk/handle/10283/2783
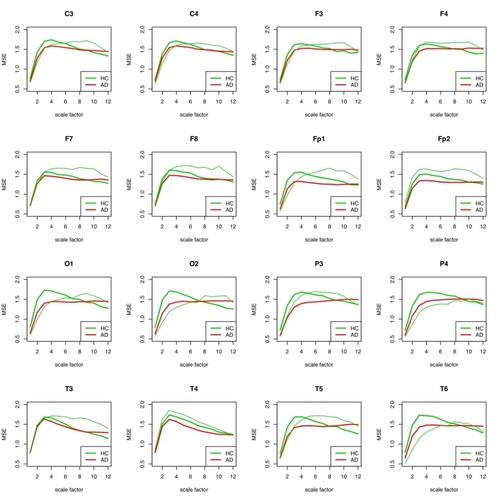
Abb. 6: MSE für jede einzelne Elektrode für Patient 2 (HC) gegenüber der Gruppe der AD-Patienten und der restlichen Gesunden aufgetragen. Die Gesunden-Einzel-Kurve ist in dünnem Grün, die Gruppen-Kurve in fettem Grün aufgetragen. In der HC-Gruppe befinden sich alle anderen HC-Probanden außer #2.
Bemerkenswert ist, dass nur in einem Skalenbereich von etwa 4-8 die Differenzierung der beiden Gruppen bei allen Elektroden gut möglich ist. Dies ist weitgehend konsistent mit den Ergebnissen von Park (2007).
Die Unterscheidbarkeit des Patienten #1 von der AD-Gruppe und der HC-Gruppe ist für weite Skalenbereiche für fast alle Elektroden gut möglich.
Die Betrachtung der Kurvenverläufe von allen AD-Patienten (12) und allen Gesunden (11) zeigt bereits bei dieser kleinen Fallzahl, dass eine Auswahl der abschätzbar „guten“ Skalenbereiche gekoppelt werden muss mit einer Auswahl geeigneter Elektroden, um eine gute Differentialdiagnose treffen zu können. Welche Elektroden dies für ein großes Patienten-Ensemble sein können, muss durch eine angemessen große Zahl von Untersuchungen ermittelt werden. Wie in den nachfolgenden Abbildungen 7 und 8 beim gleichen Vorgehen für die HFD gesehen werden kann, sind die Ergebnisse auf Gruppen-Ebene dort nur für ein großes j_max gut zu unterscheiden.
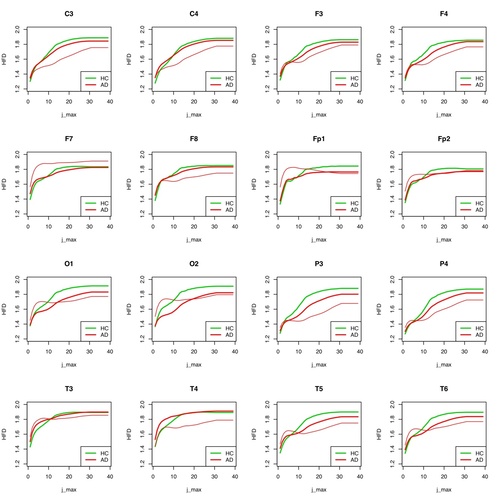
Abb. 7: HFD für jede einzelne Elektrode für Patient 1 (AD) gegenüber der Gruppe der restlichen AD-Patienten und der Gesunden aufgetragen.
Dies gilt allerdings nicht für alle Elektroden. Für T3, T4, F7, F8, Fp2, C3, C4, F3 und F4 sind bei hohen „Unterteilungs-Werten der Kurve“ (j_max) keine Unterscheidungen auf Gruppenebene möglich. Je höher der Unterteilungs-Wert j_max ist, umso mehr Teil-Abschnitte der gesamten Kurve (eine EEG-Kurve bestimmter zeitlicher Länge) werden zur Bestimmung von deren Komplexität herangezogen. Wie auch bei der MSE werden pro Elektrode für die HFD für alle gemessenen Teilsegmente deren Werte bestimmt und dann gemittelt, zum einen pro Patient, zum andern für die ganze Gruppe.
In der Abbildung 8 scheint das Ergebnis für die Gruppenunterscheidbarkeit von AD und HC bei einzelnen Elektroden etwas schlechter zu sein als in Abbildung 7. Dies gilt insbesondere für hohe Werte von j_max, für die ja eigentlich die Ergebnisse signifikant sein sollen. Es bedarf auf jeden Fall wesentlich mehr Messungen von Einzelfällen, um eine triftige Aussage treffen zu können, ob die HFD ein sinnvolles Instrument zur Unterscheidung von AD- und HC-Gruppen ist, bzw. für eine Klassifikations-Entscheidung, ob ein unbekanntes EEG-Signal eher der AD- oder der HC-Gruppe zuzuordnen ist.
Es ist momentan noch nicht klar zu erkennen, ob eine Verknüpfung von MSE und HFD einen Vorteil hinsichtlich der Verbesserung der Gruppendifferenzierbarkeit oder der Einzelfall-Klassifikation bietet.
Um diese Fragen hinreichend zu klären, wird im Berichtszeitraum 2020, wie bei Park (2007) bereits ansatzweise angesprochen, mit Klassifikations-Verfahren aus der KI eine quantitative Untersuchung der Trennschärfe der Gruppen AD und HC auf der Basis von MSE und HFD durchgeführt.
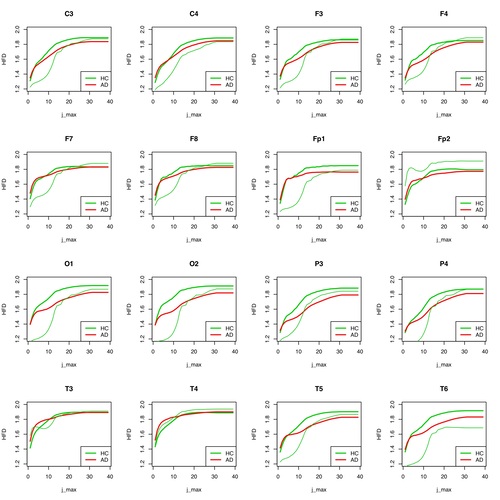
Abb. 8: HFD für jede einzelne Elektrode für Patient 2 (HC) gegenüber der Gruppe der AD-Patienten und der restlichen Gesunden aufgetragen.
Quellenangaben:
- Costa M., Goldberger A., Peng C.-K. (2002). Multiscale Entropy Analysis of Complex Physiologic Time Series. Physical Review Letters, Vol. 89, No. 6. DOI: 10.1103/PhysRevLett.89.068102
- Costa M., Goldberger A., Peng C.-K. (2005). Multiscale entropy analysis of biological signals. Physical Review E 71, 021906. DOI: 10.1103/PhysRevE.71.021906
- Park J.- H., Kim S., Kim C.- H., Cichocki A., Kim K. (2007). Multiscale Entropy Of EEG From Patients Under Different Pathological Conditions. Fractals, No. 15, Vol. 4, p. 399-404. World Scientific Publishing Company. https://doi.org/10.1142/S0218348X07003691
Arbeitspakete 4.1 - Automatische Artefakt-Entfernung durch Mustererkennung in EEG-Zeitreihen;
4.2 - Einsatz linearer und nicht-linearer Methoden in Kombination zur Zeitreihenanalyse;
4.3 - Bestimmung fraktaler Dimension/Entropie in unterschiedlichen Ausprägungen
Mit der Umsetzung der Arbeitspakete 4.1 - 4.3 wurde erfolgreich begonnen. Hierfür konnten glücklicherweise Daten zur Alzheimer-Demenz von befreundeten Forschungsgruppen aus Spanien und Italien erhalten, übernommen und hinsichtlich der Mustererkennung ausgewertet werden. Die spanischen Daten aus Valladolid wurden bereits in AP 3.1 referenziert, siehe Smith (2017). Die italienischen Rohdaten von 11 AD-Patienten stammen von der Arbeitsgruppe um Claudio Babiloni, siehe Noce (2019). Bedingt durch die COVID-19-Krise, die sich insbesondere in Italien verheerend auswirkte, konnten bislang keine vertiefenden Kontakte zu den Arbeitsgruppen in Rom und in Neapel hergestellt werden. (…)
Die Artefakt-Erkennung bei den Daten aus dem SDN (Istituto di Ricerca Diagnostica e Nucleare, siehe https://www.sdn-napoli.it/istituto/) funktioniert bereits gut. Wie sich herausstellte, gestaltete sich das Auffinden „ruhiger“ Zeitabschnitte im EEG und deren „Bereinigung“ – hier wurden eigene Methoden entwickelt (siehe Abb. 9-12) - allerdings problematischer als vorgestellt. Die Ermittlung von Epochen bzw. Segmenten in den EEG-Zeitreihen, welche die Grundlage für die Auswertung der Zeitreihen gemäß der angegebenen Parameter bilden, erfolgte noch in semi-automatischer Form und soll im Berichtsjahr 2020 nun automatisiert werden. Das wesentliche Problem besteht darin, dass die genannten Parameter nur dann korrekt ermittelt werden können (Stationaritätsbedingung, siehe https://de.wikipedia.org/wiki/Stationärer_stochastischer_Prozess), wenn sich der Proband in einem tatsächlich ruhigen Zustand befindet, also an nichts Wesentliches denkt, so dass auch keine Veränderungen im Signal auftreten, wie z. B. Trendanstiege, die dann ggf. missverstanden werden könnten als Teile von z. B. nicht richtig erkannten Muskel-Artefakten.
Es sollte bei der EEG-Untersuchung gewährleistet sein, dass sich das Gehirn des Probanden im sogenannten Default mode (eine Art Autopilot des Gehirns, siehe https://en.wikipedia.org/wiki/Default_mode_network) befindet, da Abweichungen des EEG in diesem als definierten „eigentlichen“ Ruhezustand Hinweise auf pathologische Zustände wie AD liefern, welche auch mit anderen Untersuchungsmethoden wie fMRI oder MEG bestimmt worden sind. Der Default mode fungiert hier als eine Art Referenzstatus.
In unseren bisherigen Arbeiten stellte sich heraus, dass die Entropie die ergiebigste Größe zur Differenzierung von Menschen mit Alzheimer-Demenz und Gesunden auf Gruppenebene ist. Ziel ist bei ihrer Bestimmung die individuelle Prognose des Krankheitsverlaufs, wie unter 3.1. bereits als erster Schritt beschrieben wurde. Hierbei muss zusätzlich die Synchronizitäts-Störung, die bei Alzheimer-Demenz auftritt, auch auf individueller Ebene in signifikanter Größenordnung ermittelt werden. Dies soll u. a. über graphentheoretische Analysen des Resting-State-Networks (rsn), insbesondere des darin enthaltenen default-mode-networks (DMN) und sogenannter EEG-Microstates (siehe Smailovic et al (2019)) und hierbei auch des Verlusts der Phasen-Synchronizität an ausgewählten Stellen des DMN erfolgen. Dies sind die Resultate der Literatur-Recherchen im Berichtszeitraum 2019, die im neuen Jahr anhand des gegebenen Datenbestands näher untersucht werden sollen.
In den nachfolgenden Abbildungen 9-12 werden die Ergebnisse der semi-automatischen Bestimmung der für die EEG-Analyse relevanten „ruhigen Segmente“ innerhalb von definierten Mess-Epochen, z. B. wie hier mit 620 Sekunden angezeigt, der EEG-Messzeit des Patienten SDN_011 (SDN – Bedeutung siehe oben). Hierbei werden nur die Ergebnisse für Kanal 1 = Fp1 (frontal links) angegeben. Es kommt auf die Artefakt-Erkennung somit nur insofern an, als dass möglichst ruhige EEG-Segmente für die EEG-Analyse erforderlich sind, da diese nur bei Einhaltung nahezu stationärer Bedingungen für das EEG-Signal (kein veränderlicher Mittelwert, kein Trend) überhaupt aussagekräftig ist.
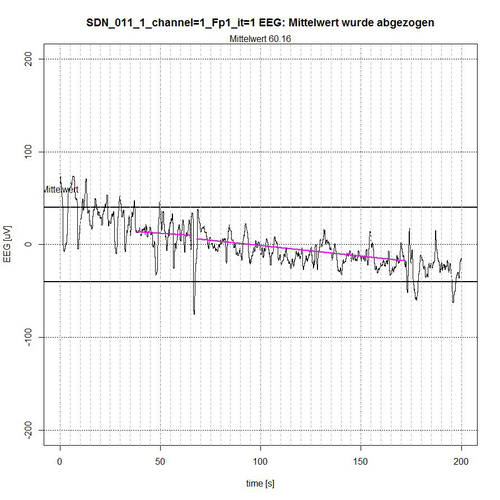
Abb. 9: Zeitabschnitt I (Sekunde 0-200) von SDN 11 für Kanal Fp1, 2 ruhige Segmente gefunden.
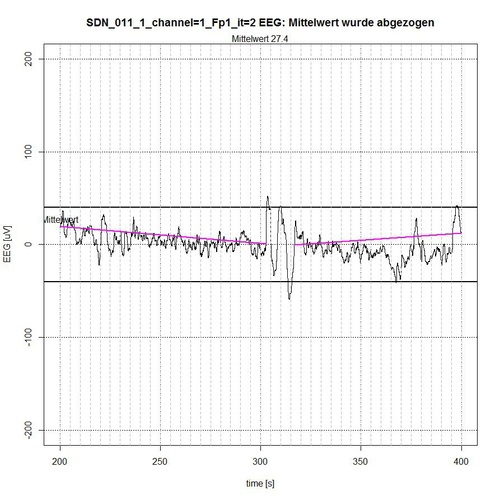
Abb. 10: Zeitabschnitt II (Sekunde 200-400) von SDN 11 für Kanal Fp1, 2 ruhige Segmente gefunden.
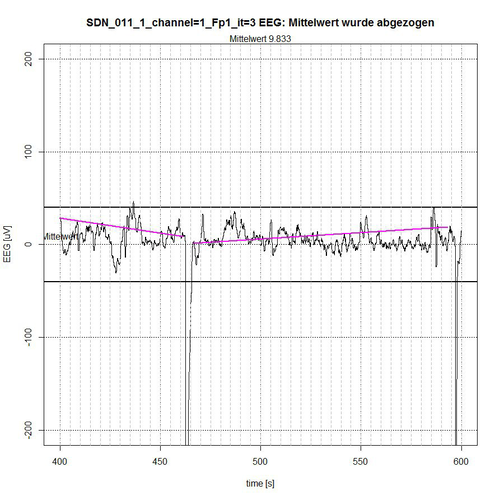
Abb. 11: Zeitabschnitt III (Sekunde 400-600) von SDN 11 für Kanal Fp1, 2 ruhige Segmente gefunden.
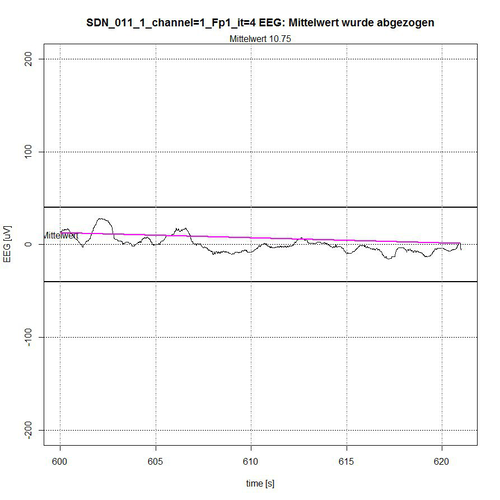
Abb. 12: Zeitabschnitt IV (Sekunde 600-620) von SDN 11 für Kanal Fp1, 1 ruhiges Segment gefunden.
Beschreibung der Abbildungen 9-12:
Das gesamte EEG-Signal wurde in 4 Zeit-Abschnitte zerlegt. Das Signal wird begrenzt durch ein -50-µV-Intervall, angezeigt durch zwei fett gezeichnete Linien ober- bzw. unterhalb der Null-Linie. In jedem Zeit-Abschnitt wird der Mittelwert des aufgetragenen Signals aus Normierungsgründen abgezogen, so dass ein Bezug zur Null-Linie erhalten bleibt. Der Algorithmus ermittelt diejenigen Segmente, die sich vollständig innerhalb des -50-µV-Intervalls befinden und schließt dabei Segmente aus, die sich als zusammengehörige Sequenz von EEG-Werten erkennbar wiederholend außerhalb des Begrenzungs-Intervalls befinden, siehe Abb. 9 (Sekunde 0-37 und Sekunde 172-200) und Abb. 10 (Sekunde 303-316) oder deren Peak-Wert (es handelt sich um Spikes, d.h. kurzzeitige Spitzen) weit außerhalb des Akzeptanz-Intervalls von -50 µV liegt, siehe Abb. 9 (Peak bei Sekunde 67) und Abb. 11 (Peaks bei Sekunde 464 und Sekunde 596).
Der Algorithmus schließt Grenzfälle von EEG-Werten bei der Akzeptanz von Segmenten mit ein, wenn deren (einzelne) Peak-Werte sich nur kurzzeitig und nur mit einigen µV außerhalb des Akzeptanz-Intervalls befinden, wie in Abb. 9 bei Sekunde 50, in Abb. 10 bei Sekunde 397 und in Abb. 11 bei Sekunde 437 zu erkennen ist. Die Linien in der Farbe Magenta geben dann die Verbindung vom Anfangspunkt des ermittelten akzeptierten Segments zum Endpunkt des ermittelten akzeptierten Segments an. Sie stellen allerdings noch keinen Trend dar, der in erster Instanz durch eine lineare Trendanalyse für dieses Segment ermittelt werden kann, um die Stationaritätsbedingung zu überprüfen.
Eine zentrale Frage, welche sich uns im Berichtszeitraum 2020 stellen wird, ist die nach der bedeutungsvollen Segmentierung der EEG-Signale, d. h. die Segmentierung gemäß der Detektion nicht nur von muskulären oder Augen-Artefakten, sondern auch von EEG-Ereignissen, die auf die nicht vollständige Entkopplung der EEG-Messung vom Denkprozess zurückzuführen sind. Daher werden wir einen Schwerpunkt bei der Gewinnung signifikanter EEG-Segmente im Ruhezustand darauf legen, dass sich die Probanden im DM (default mode)-Zustand des Gehirns befinden, damit gewährleistet ist, dass kein zielgerichtetes Denken während der EEG-Aufnahme stattfindet. Hilfsmittel hierfür kann auch die Analyse des EEG-Signals mit der MSE (siehe AP 3.1) sein, weil anzunehmen ist, dass sich das EEG-Signal im DM durch geringere Gamma-Anteile auszeichnet, was sich eventuell in einer niedrigeren Entropie niederschlägt. Dies bleibt im neuen Berichtszeitraum für das Jahr 2020 zu untersuchen.
Quellenangaben:
- Noce G. (2019). Raw data-Abnormalities of Resting State Cortical EEG Rhythms in Subjects with Mild Cognitive Impairment Due to Alzheimer's and Lewy Body Diseases. Mendeley Data, v2. http://dx.doi.org/10.17632/ncxcw6g324.2. Mendeley Data unter https://data.mendeley.com/datasets/ncxcw6g324/2
- Babiloni C., Del Percio C., Lizio R., Noce G., … Bonanni L. (2018). Abnormalities of Resting State Cortical EEG Rhythms in Subjects with Mild Cognitive Impairment Due to Alzheimer’s and Lewy Body Diseases. Journal of Alzheimer's Disease, vol. 62, no. 1, pp. 247-268, 2018. DOI: 10.3233/JAD-170703. siehe https://content.iospress.com/articles/journal-of-alzheimers-disease/jad170703
- Smailovic U., Koenig Th., Laukka E., Kalpouzos G., Andersson Th., Winblad B., Jelic V. (2019). EEG time signature in Alzheimer´s disease. Functional brain networks falling apart. NeuroImage: Clinical 24 (2019) 102046. https://www.sciencedirect.com/science/article/pii/S2213158219303936

 Deutsch
Deutsch  English
English